Исследователям из Колумбийского университета удалось решить одну из главных проблем медицинской электроники. Они научились использовать ионные каналы клеточных мембран и энергию АТФ для питания микросхем в корпусе BGA. Грань между биологическим и искусственным становится всё более размытой, а трансгуманизм – всё ближе.
Развитие имплантируемой электроники сдерживается многими факторами, одним из которых остаётся проблема питания. До сих пор искусственные органы используют массивные внешние аккумуляторы, а дефект встроенной батареи у водителя ритма часто приводит к внезапной смерти больных с полной АВ-блокадой. Простейший имплантируемый датчик – и тот требует своего источника питания, пускай и маломощного.
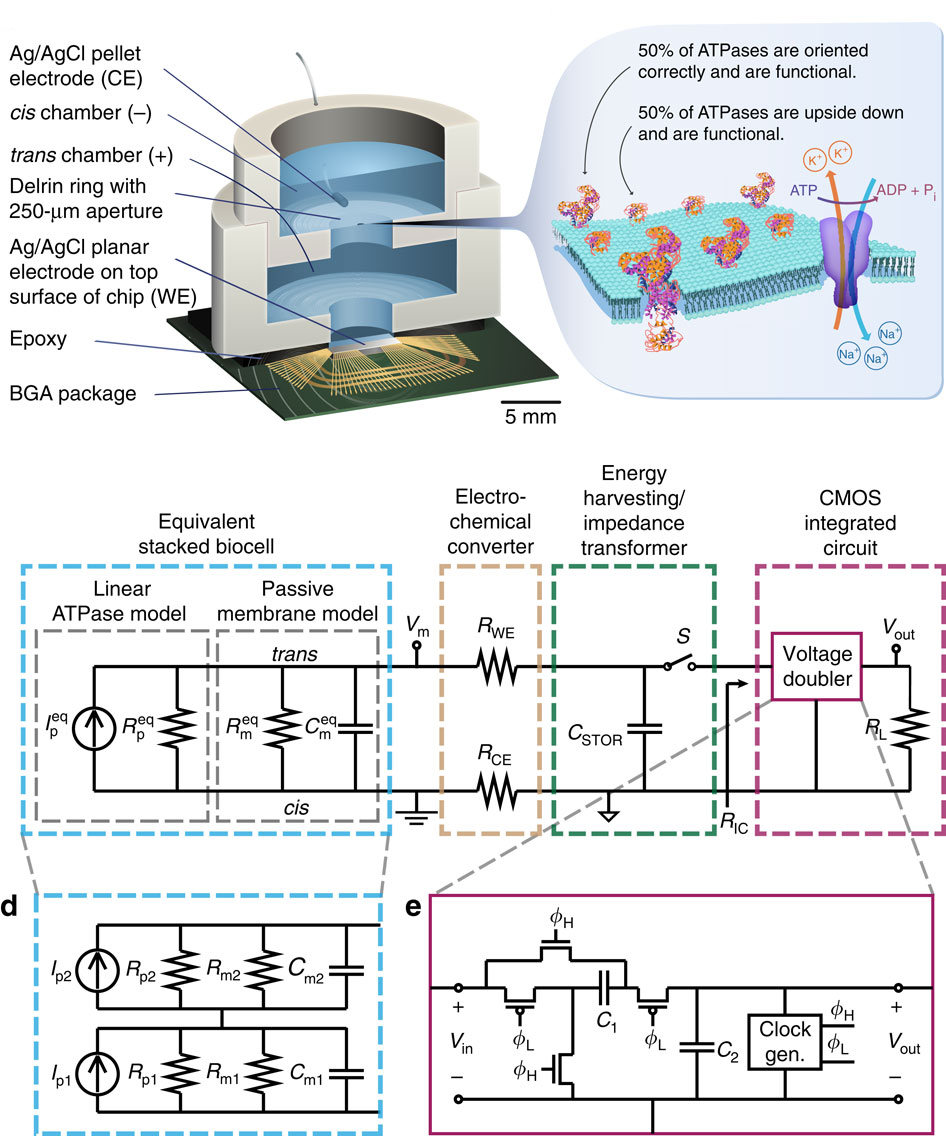
Проблема состоит в том, что биологи обычно плохо разбираются в электротехнике, а инженеры совсем не смыслят в биологии. Поэтому для каждого из них задача кажется неразрешимой. Узкие специалисты акцентируют внимание на только им известных деталях вместо того, чтобы попытаться представить общую картину и дополнить её вместе. Долгожданный прорыв был осуществлён именно сообща – на кафедре электротехники Колумбийского университета при поддержке коллег из Брауновского университета и университета Пьюджет Саунд. Ниже приводится схема питания CMOS BGA чипа от клеточной мембраны (кликабельное изображение: Jared M. Roseman et all. / Nature Communications).
Примечание от техников.
В эксперименте исследователи создали двуслойную липидную мембрану. По строению она аналогична мембране живой клетки, только без «лишних» элементов. На каждом квадратном миллиметре её поверхности естественным образом формируются 2 × 106 натрий-калиевых ионных каналов, работающих за счёт энергии гидролиза АТФ. Они в состоянии выдержать ток силой 32,6 пA / мм2 и создают разницу потенциалов 78 мВ. Такая мембрана способна отдавать энергию подключённой нагрузке, обеспечивая мощность до 1,27 пВт с каждого квадратного миллиметра своей площади. Тонкая плёнка серебра/хлорида серебра играет роль ион-электронного преобразователя.
Примечание от биохимиков.
Во время гидролиза АТФ высвобождается энергия, запасённая в виде химических связей. Сначала разрывается концевая фосфоангидридная связь, что приводит к образованию АДФ, ортофосфата и выделению энергии. В стандартных условиях её образуется 30,54 кДж на один моль (60,22 Дж/г). В живой клетке из-за более высокой температуры реальное значение оказывается выше – около 50 кДж/моль (99 Дж/г). Затем в молекуле АДФ может разрушиться вторая связь и выделиться дополнительная энергия.
Серия опытов показала, что две мембраны в конструкции «бутерброда» уже обеспечивают достаточное напряжение, чтобы управлять интегральной схемой. Эффективность преобразования химической энергии в электрическую по тестам авторов технологии составила 14,9 %. Попытки найти альтернативные источники энергии продолжаются. Создаются пьезо-, термо-, фото-, механо- и какие угодно ещё X-электрические преобразователи энергии. Однако в медицинском аспекте все они меркнут на фоне заманчивой перспективы – непосредственно утилизировать энергию биохимических процессов так, как это делают живые клетки.
Конечно, от одной-двух клеточных мембран получить всю необходимую для имплантируемой электроники энергию невозможно в принципе. Однако любая батарея – это объединение маломощных генерирующих элементов, которых здесь может быть не один миллион. Для сравнения: организм человека состоит примерно из 1014 клеток, а каждую минуту их погибает свыше 108. Нервные клетки млекопитающих содержат в двадцать раз больше натрий-калиевых ионных каналов, чем сформировалось в описанной искусственной мембране. Идея братьев Вачовски о людях-батарейках на проверку оказалась не такой уж фантастической.