Учёные из научно-исследовательского института Скриппса (TSRI) в Калифорнии модифицировали бактерию E. coli, введя в код её плазмидной ДНК два новых комплементарных соединения, не встречающихся в природе. Так научная группа получила первый в мире полусинтетический живой организм и навсегда изменила генетику. Одним из авторов работы указан наш соотечественник — научный сотрудник Денис Малышев. Он учился в Московском химическом лицее, после чего окончил Российский химико-технологический университет им. Д. И. Менделеева и эмигрировал в США.
Современных биологов и биохимиков вполне можно считать программистами. Ведь они освоили самый низкоуровневый язык, который только можно представить, — генетический код. Прямое вмешательство в него похоже на реверс-инжиниринг. Оно стало возможным совсем недавно и совершило настоящий переворот в биотехнологиях.

Примерно до восьмидесятых годов XX века селекционеры действовали вслепую, опираясь на внешние признаки и закономерности их наследования. Даже таким неоптимальным способом порой совершались удивительные по своим масштабам достижения. К примеру, лауреата Нобелевской премии Нормана Эрнеста Борлоуга называют «отцом Зелёной и Белой революции» за то, что он смог вывести сорта пшеницы и риса с исключительной урожайностью. По данным ООН, это уже спасло от голодной смерти около миллиарда человек и помогло сохранить само существование Мексики, Индии и Пакистана.
Иногда метод проб и ошибок приводил к досадным просчётам. Например, кроме повышения урожайности картофеля и томатов новых сортов, в них повышался уровень содержания токсинов, типичных для всего семейства паслёновых. Такие сорта забраковывались, но никто не мог вернуть годы потраченного времени. Проблема сдерживания генетики состоит именно в страхе перед сложными технологиями, а не в опасности самой изменённой ДНК. Ведь абсолютно любой организм (кроме своего собственного) является для нас генетически чужеродным.
Новые биотехнологические методы позволяют избежать подобных ошибок, сразу внося в генотип контролируемые изменения. Помимо растений, этот метод широко применяется у бактерий, поскольку, кроме собственной ДНК, они содержат ещё и удобную для работы плазмидную. Модифицированные штаммы превращаются в завод по производству сложных белков, наиболее востребованных в медицине. Среди них есть инсулин, эритропоэтин, интерферон и другие. По данным ВОЗ, один только генно-инженерный инсулин спасает от тяжёлых осложнений и смерти сотни миллионов человек во всём мире.
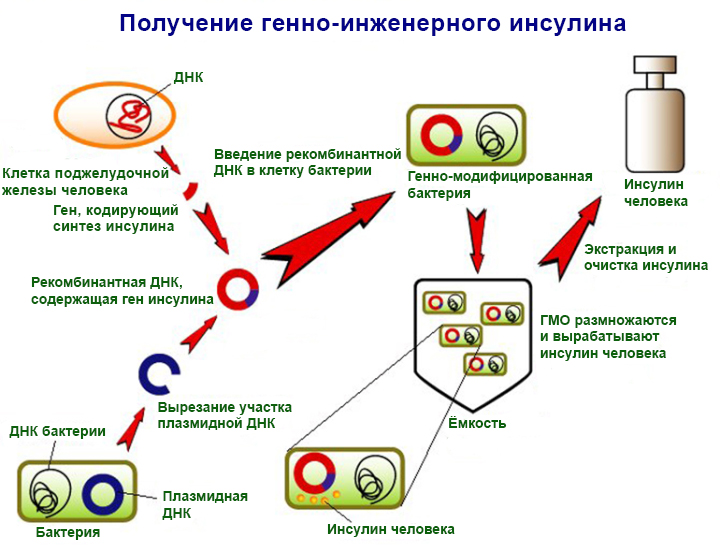
Сегодня качество нашей жизни напрямую зависит от того, как быстро мы сможем разобраться в деталях синтеза белка и научиться управлять этим процессом. Простых методов изменения генома уже недостаточно: требуется расширять сам язык генетического программирования, вводя в него новые операторы. Именно это и сделали в институте Скриппса, объединив результаты научных работ по данной теме за более чем двадцатилетний период.
В природе нуклеиновые кислоты всех живых существ содержат только четыре азотистых основания: гуанин (G), аденин (А), тимин (Т) и цитозин (С) в ДНК, плюс неметилированную форму тимина (урацил — U) в РНК. Каждый участок из трёх последовательно расположенных оснований формирует кодон, в котором и зашифрована команда на синтез определённой аминокислоты, либо сигналы «старт/стоп».
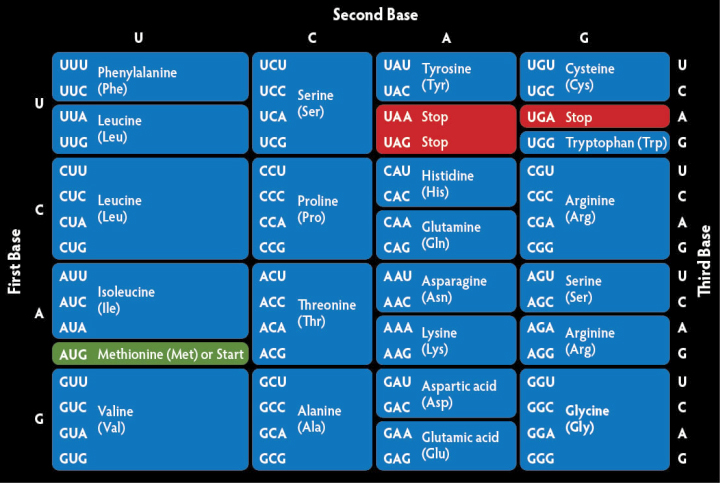
При большом химическом разнообразии аминокислот как группы веществ, белки любого живого организма состоят всего из двадцати L-альфа-аминокислот. Их положение определяет структуру протеинов и их биологические свойства.
Данный код характеризуется избыточностью: некоторые аминокислоты могут кодироваться разными способами. Например, к синтезу аргинина внутри клетки приведёт запись CG*, где * — любое третье основание. Поэтому, несмотря на трёхбуквенную систему, в процессе биосинтеза белка образуются не 64=43, а всего двадцать разных вариантов аминокислот. Редко встречающиеся селеноцистеин, пирролизин и другие «нестандартные» альфа-аминокислоты не нарушают этого правила. Они выпадают из общего списка, так как образуются иначе — путём модификации одной из основных аминокислот уже после её синтеза.
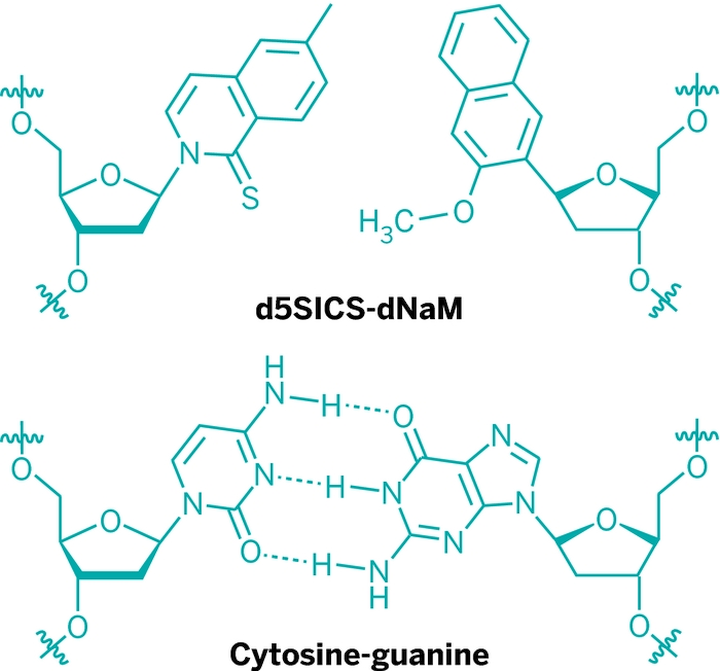
В лабораторных условиях, помимо AT(U)GC, можно использовать и другие кодирующие молекулы — такие как d5SICS и dNaM. Добавление всего пары синтетических соединений к стандартному набору азотистых оснований фактически создаёт новый генетический алфавит. С его помощью можно закодировать биосинтез уже не двадцати, а ста семидесяти двух аминокислот. Число новых вариантов белка, который можно синтезировать из них, становится просто астрономическим.
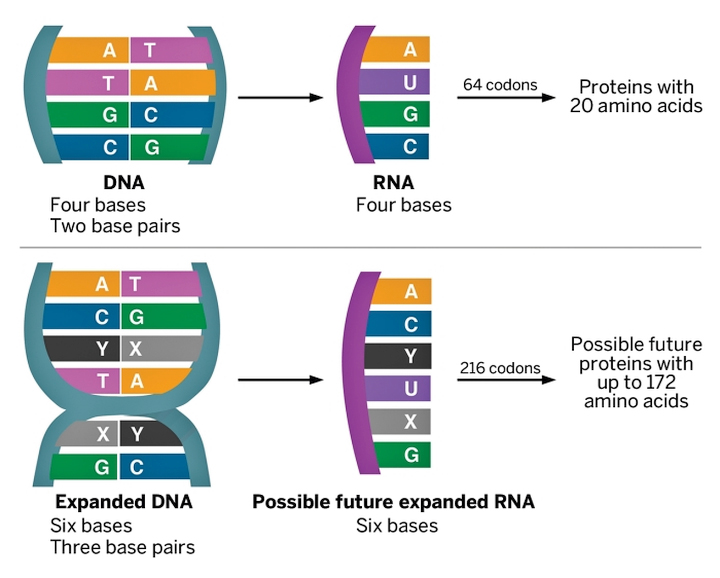
«В принципе, мы могли бы кодировать совершенно новые белки, сделанные из не встречающихся в природе аминокислот, — поясняет руководитель группы Флойд Ромсберг (Floyd E. Romesberg). — Это дало бы нам бо́льшую власть, чем когда-либо. Мы могли бы адаптировать технологию для создания белковых терапевтических и диагностических средств, лабораторных реагентов и многого другого. Такие аспекты применения, как наноматериалы, тоже возможны».
Соединения d5SICS и dNaM связываются между собой через гидрофобные взаимодействия, в то время как природные образуют водородные связи. Это не мешает использовать их для расширения генетического алфавита, но создаёт ряд преодолимых трудностей.
Экспериментальный штамм бактерий с изменённым генотипом содержит эти два новых основания и сохраняет жизнеспособность, однако пока не даёт потомства самостоятельно. Для размножения модифицированных бактерий требуется ряд ручных манипуляций с раствором — таких как добавление фосфатных соединений, получаемых из водорослей.
«Важно отметить, что это также обеспечивает контроль над системой, — говорит Денис Малышев. — Наши новые соединения могут поступать в клетку только при помощи белков-переносчиков. Без них клетка вернётся к стандартному набору ATGC, а молекулы d5SICS и dNaM исчезнут из её генома».
Авторы исследования рассчитывают, что в дальнейшем найдётся способ создать полностью синтетический и способный к размножению штамм бактерий. Для этого требуется аналогичным способом расширить «алфавит» РНК и, возможно, изменить сами рибосомы.